L’Ecdc ha effettuato un’analisi dettagliata delle indicazioni adottate nei Paesi UE/SEE dopo i casi di eventi trombolitici. In particolare sono 15 i Paesi che hanno previsto limiti di età consigliati (tra cui l’Italia), 12 che non hanno posto limiti ma seguono alla lettera le indicazioni dell’Ema, 19 che raccomandano la seconda dose con lo stesso vaccino (tra cui l’Italia), mentre 5, per la seconda iniezione, consigliano un vaccino mRna e 2 lo hanno proprio cancellato dalla loro campagna. LO STUDIO
27 MAG – Nel marzo 2021, a seguito della notifica di casi di coaguli di sangue con basse piastrine in persone che avevano ricevuto il vaccino di AstraZeneca “Vaxzevria”. il Pharmacovigilance Risk Assessment Committee (PRAC) dell’Agenzia Europea dei Medicinali ha avviato come è noto una revisione dettagliata dei dati di sicurezza sui casi di eventi tromboembolici ricevuti tramite il database EUDRAVIGILANCE.
Il 16 aprile 2021, l’EMA PRAC ha concluso che gli eventi tromboembolici associati alla trombocitopenia (TTS) sono un effetto collaterale molto raro di Vaxzevria e la scheda informativa del prodotto è stata aggiornata di conseguenza.
Sulla base di una revisione dei dati sulla vaccinazione e l’epidemiologia della malattia, il comitato per i medicinali per uso umano (CHMP) dell’EMA ha concluso che i benefici complessivi di Vaxzevria superano i rischi di eventi avversi, inclusa la TTS.
Tuttavia, il beneficio della vaccinazione con Vaxzevria – in termini di ricoveri evitati, ricoveri in terapia intensiva e decessi – aumenta con l’aumentare dell’età e dei tassi di infezione.
Le raccomandazioni dell’EMA in termini di una seconda dose di Vaxzevria rimangono in linea con le informazioni sul prodotto (cioè un intervallo di 4-12 settimane).
A fronte di queste indicazioni, tuttavia, le autorità regolatorie nazionali dei diversi Paesi della UE non hanno reagito allo stesso modo.
A fornire un quadro completo delle diverse indicazioni prescrittive sull’uso del vaccino di AstraZeneca è l’Ecdc che ha effettuato una analisi completa delle decisioni adottate dai Paesi UE/SEE (vedi tabella a fine articolo).
Complessivamente sono 15 i paesi dell’UE/SEE ad avere adottato raccomandazioni specifiche per somministrare Vaxzevria solo a determinati gruppi di età, nella maggior parte dei casi gli anziani al di sopra di una certa età (tra questi Paesi anche l’Italia).
Un totale di 12 paesi raccomandano l’uso di Vaxzevria sulla base dell’attuale riassunto delle caratteristiche del prodotto dell’EMA (con alcune eccezioni legate alla storia o al rischio di eventi tromboembolici e donne in gravidanza).
Due paesi ne hanno invece interrotto l’uso.
Inoltre, 19 paesi dell’UE/SEE raccomandano attualmente la somministrazione di Vaxzevria come seconda dose in soggetti che hanno già ricevuto una prima dose di Vaxzevria (Italia compresa).
Ciò include sei paesi con raccomandazioni riviste in termini di limiti di età, ma in cui la seconda dose di Vaxzevria è comunque raccomandata a tutti gli individui che hanno ricevuto la prima, indipendentemente dall’età.
Cinque paesi hanno invece rivisto le loro raccomandazioni e somministreranno la seconda dose con un vaccino mRNA (Comirnaty di BioNTech / Pfizer o COVID-19 Vaccine Moderna).
Le opzioni per completare un ciclo di vaccinazione dopo la somministrazione di una prima dose di Vaxzevria includono:
• Vaxzevria come seconda dose a tutti coloro che hanno ricevuto la prima dose;
• vaccino mRNA COVID-19 come seconda dose;
• un altro vaccino vettore adenovirus come seconda dose;
• nessuna seconda dose o intervallo ritardato tra la prima e la seconda dose.
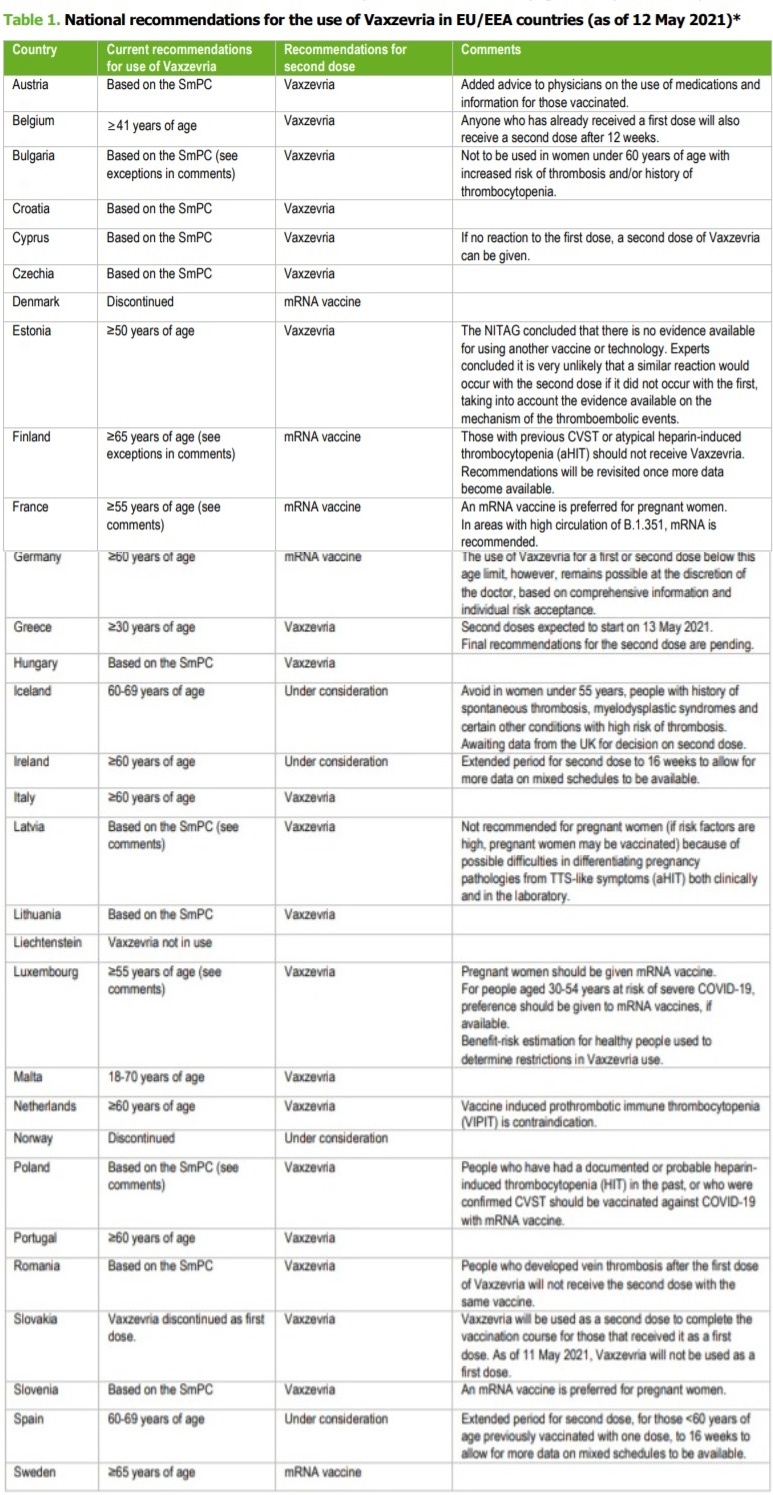
Nota: la sigla SmPC indica il Summary of Product Characteristics di Ema
27 maggio 2021
Clicca sull'immagine per aprire il file in formato PDF





